|
|
|
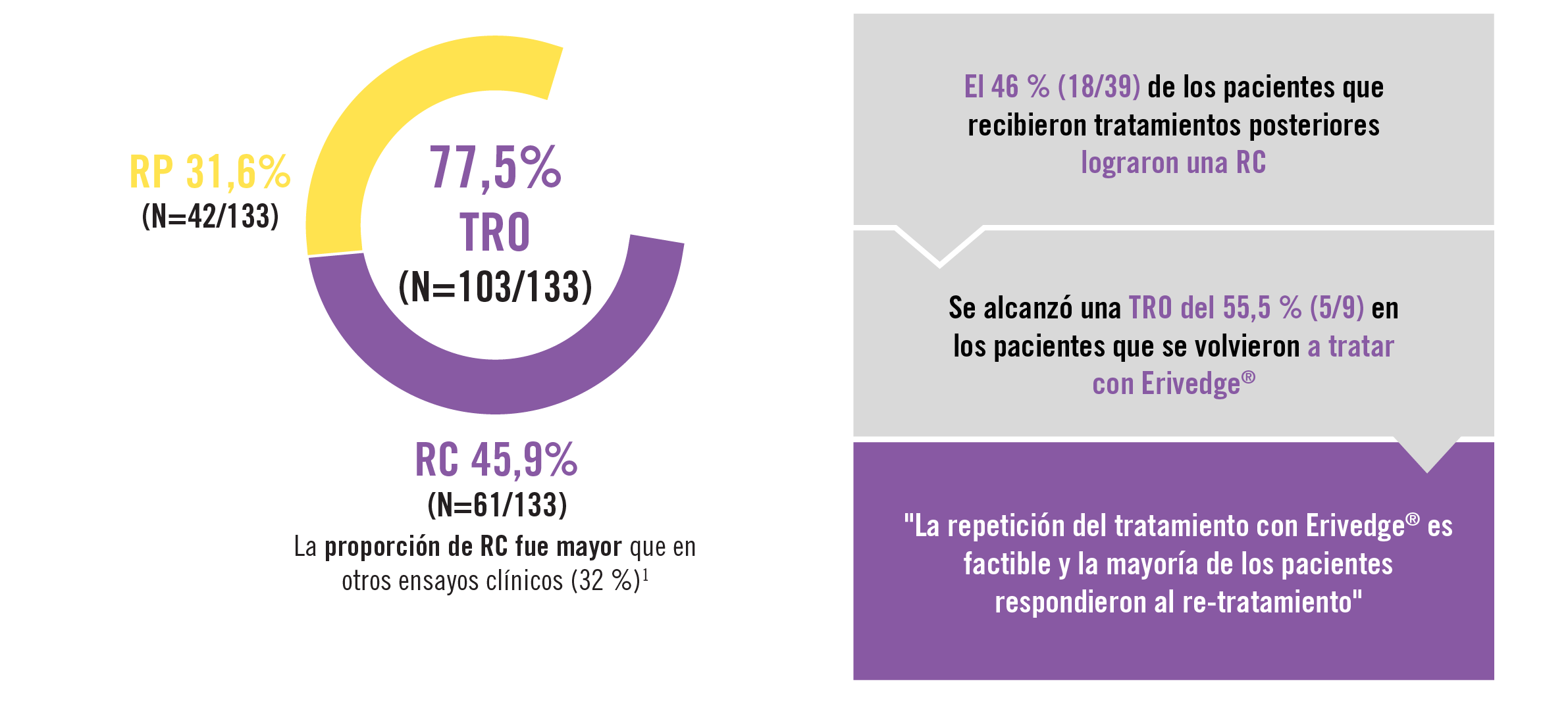
| Eficacia de Erivedge® tras una mediana de duración del tratamiento de 32,5 semanas (20,9-56,1)1 |
|
| Motivos más frecuentes de interrupción de Erivedge®1 |
|
|
|
Los EA grado 3/4 más frecuentes fueron calambres musculares (8 pacientes; 6,0 %), astenia (3 pacientes; 2,3 %) y pérdida de peso (2 pacientes; 1,5 %). |
El riesgo de recidiva tras lograr una RC con Erivedge® fue menor que en informes anteriores. El estudio RELIVIS confirma la seguridad y la eficacia de Erivedge® en el CBCa1 |
|
|
| M-ES-00013530 |
|
| CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN Medicamento sujeto a prescripción médica. Diagnóstico Hospitalario de dispensación hospitalaria. 12. PRESENTACIÓN Y PRECIO Presentación y precio de Erivedge® 150 mg cápsulas duras: Envase de 28 cápsulas C.N. 698799.5; PVP IVA notificado (no SNS): 5.882,15€. Precio financiado por el SNS (consultar). |
| Visítenos |